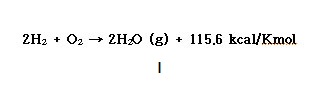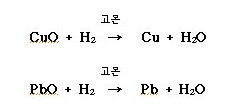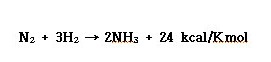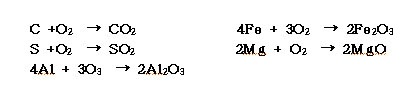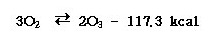|
③ LP 가스의 일반적인 특성
ⓐ LP 가스는 공기보다 무겁다.
LP가스의 기체상태에서 비중은 공기(비중=1)보다 크므로 누설시 대기 중으로 확산되지 않고 낮은 곳으로 모여서 인화 위험성이 크다.
ⓑ 액상의 LP 가스는 물보다 가볍다.
ⓒ 기화, 액화가 용이하다.
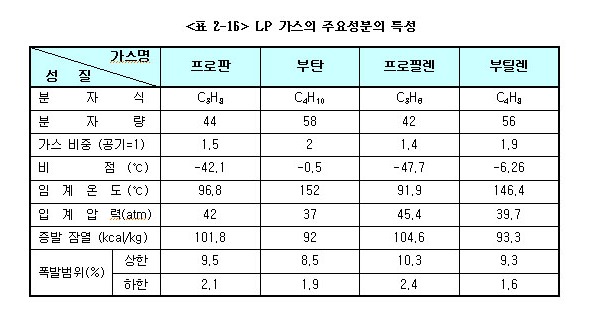
상온에서 프로판은 약 7kg/㎠으로 가압하거나 상압(대기압)하에서 프로판은 -42.1℃, 부탄은 -0.5℃로 냉각하면 쉽게 액화한다.
ⓓ 기화하면 체적이 커진다.
액체상태의 LP가스가 기화하면 프로판은 250배, 부탄은 230배로 각각 체적이 늘어난다.
ⓔ 증발잠열(기화열)이 크다.
기화열이란 어느 액체 1g이 일정한 압력하에서 같은 온도의 기체가 되는데 필요한 열량을 말하며, 이것은 기체가 액화될 때에 방출하는 열량과 같다. (프로판 : 101.8 kcal/kg, 부탄:92.1 kcal/kg)
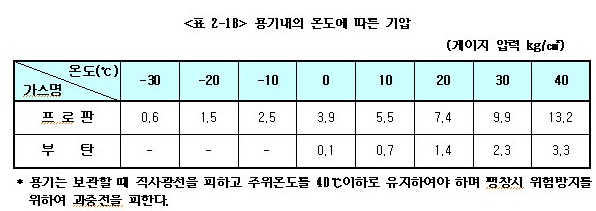
ⓕ 용기 내의 기압은 온도, 가스의 종류에 따라 다르다.
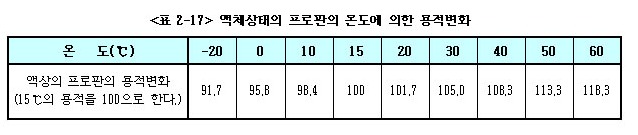
아래 <표 2-18>는 용기내의 온도에 따른 기압을 보인 것이다.
ⓖ 무색, 무취, 무독이다.
순수한 LP가스는 무색, 무미, 무취이며 중독성이 없으나 많은 양을 흡입하면 신경마비를 일으킨다. 누설시의 인화폭발 위험을 방지하기 위하여 공기 중의 1/1000의 가스가 존재해도 사람이 감지할수 있도록 일정
의 향료를 첨가 하도록 되어 있다.
ⓗ 용해성이 있다.
고무, 페인트, 그리스 및 윤활유 등을 용해하는 성질이 있으므로 가스를 취급하는 기기에 사용되는 고무, 밀봉제등은 내유성을 갖는 특수한 것을 사용하여야 한다.
* 참고 *
LP가스는 그리스, 광물유, 와니스 등의 물질을 용해한다. 또 천연고무에 현저한 팽창을 야기시킨다. 따라서 배관이나 배관 접합부에 쓰이는 금속 이외의 실재 또는 패킹재, 고무호스 등은 LP가스에 견디는
힘이 강한 성질의 것을 사용하지 않으면 안된다.
④ LP가스의 연소특성
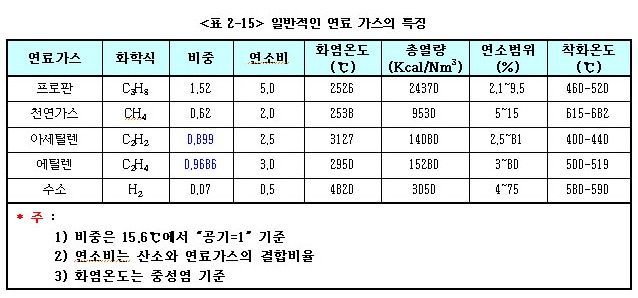
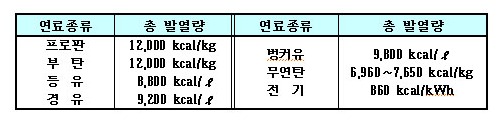
ⓐ LP가스는 타 연료에 비하여 발열량이 크다. 아래 표는 연료 종류에 따른 발열량을 비교한 것이다.
ⓑ 연소시 많은 공기가 필요하다.
㉮ 프로판 연소반응식 : C3H8 +5O2 → 3CO2 + 4H2O + 530 kcal/mol
㉯ 부탄 연소 반응식 : C4H10 +6.5O2 → 4CO2 + 5H2O + 700 kcal/mol
위 반응식에서와 같이 필요한 공기량은 프로판 1㎥에 24㎥, 부탄 1㎥에 31㎥를 필요로 한다. 단, 공기 중에 산소는 21%가 포함되어 있다.
㉰ LP가스가 불완전 연소되면 일산화탄소가 발생한다. 일반적으로 환기가 나쁜 곳에서 연소시키면 시간이 경과됨에 따라 공기 중의 산소농도는 낮아지고 일산화탄소, 탄산가스의 농도는 증가한다. 또한
일산화탄소 농도는 공기 중의 산소농도가 18% 이하일 경우 급격히 증가한다.
(라) LNG (액화천연가스, Liquified Natural Gas)
LNG는 Liquified Natural Gas의 약자로서 메탄(CH4)을 주성분으로 한 천연가스를 냉각해서 액화한 상태의 가스이다. 천연가스는 유전, 가스전에서 산출되며, 탄화수소를 주성분으로 하는 가연성 가스이다.
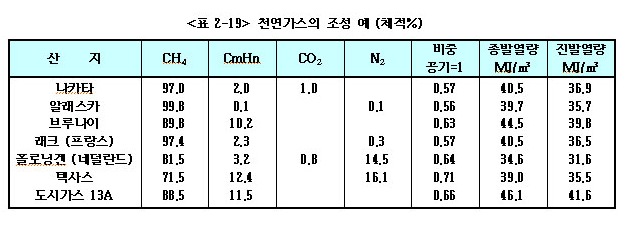
국내 천연가스의 주 도입지역은 알래스카, 브루나이, 아부다비, 인도네시아, 말레이시아, 호주 등이며 주로 액화 천연가스(LNG)이다. <표2-19>에 나타낸 것처럼 천연가스는 산지마다 조성이 다르고, 총발열량
또한 도시가스에서 요구하는 총발열량 46.1MJ/㎥에 부족함으로 LPG를 첨가하여 열량을 조정하여 사용하고 있다.
① 천연가스(NG : Natural Gas)의 특징
천연가스는 지하에서 발생하는 탄화수소를 주성분으로 한 가연성 가스의 총칭으로 매설된 상태에 의해 구조성 가스, 수용성가스, 탄공 가스로 분류된다. 또한 구조성 가스 중에는 원유와 더불어 산출되는 습성 가스와 액화성분을 포함하지 않는 건성가스가 있다.
ⓐ 천연가스의 성질과 상태
㉮ 천연가스는 산지에 의해 조성의 차이는 있지만 메탄(CH4), 에탄(C2H6), 프로판(C3H8), 부탄(C4H10) 등의 저급 탄화수소를 성분으로 하고, 이외에 소량이지만 질소(N2), 탄산가스(CO2) 등의 불연성 가스나 불순
물로서 황화수소(H2S)를 함유하고 있다.
㉯ 유전가스에서 산출되는 천연가스는 수분(H2O)을 포함하고 있다.
㉰ 황화수소(H2S)는 매우 유독하고 부식성이 강하며, 연소에 의해 유독한 SO2를 생성하기 때문에 탈황을 할 필요가 있다. 2003년 12월 중국 충칭의 천연가스 생산지에서 유독한 H2S가 누출되어 많은 사람이 사망한
경우도 있다.
㉱ CO2는 H2O와 공존하는 경우 도관을 부식시키기 때문에 탈황공정에서 동시에 제거한다.
㉲ 천연가스를 고압 수송하면 수분의 응축에 의해 수송 장해를 일으키거나 천연가스와 수분이 결합해서는 눈 같은 고체상의 물질을 생성해 도관, 밸브 등을 폐쇄할 경우가 있어 수분을 제거해서 수송한다.
ⓑ 천연가스를 도시가스로 사용할 경우의 특징
㉮ 천연가스를 그대로 공급한다. (9,000 ~ 9,500 kcal/N㎥)
㉯ 천연가스를 공기로 희석해서 공급하게 한다. (4,500 ~ 6,000 kcal/N㎥)
㉰ 종래의 도시가스에 섞어서 공급한다.
㉱ 종래의 도시가스와 유사성질의 가스로 개질하여 공급한다.
② LNG의 특징
ⓐ LNG의 성질과 상태
㉮ LNG는 약 -162℃의 비점을 가지는 무색투명한 액체이며, 비점 이하의 저온에서는 단열용기에 저장할 수 있다.
㉯ LNG로부터 기화한 가스는 무색, 무취로 약 -113℃이하에서는 건조된 공기보다 무겁지만, 그 이상의 온도에서는 가볍다.
㉰ LNG는 메탄올 주성분으로 에탄, 프로판, 부탄류, 펜탄류 등 저급 지방족 탄화수소와 질소가 소량 함유되어 있다.
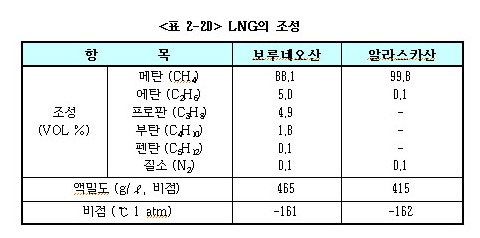
㉱ LNG의 조성은 아래 <표 2-20>에 표시하는 바와 같이 원료인 천연가스의 산지와 정제 액화 방법에 따라 다소차이가 있다.
㉲ LNG의 주성분인 메탄은 1kg당 표준상태 (0℃, 1기압)에서 가스상으로 약 1.4㎥이지만, 이것을 -162℃, 1기압으로 액화하면 불과 0.0024㎥로 되어 체적은 약 1/600이 줄어든다. 이것을 이용하여 대량의 천연가스를
액상으로 수송하는 것을 이용하게 할 수 있다.
ⓑ LNG의 폭발성 및 인화성
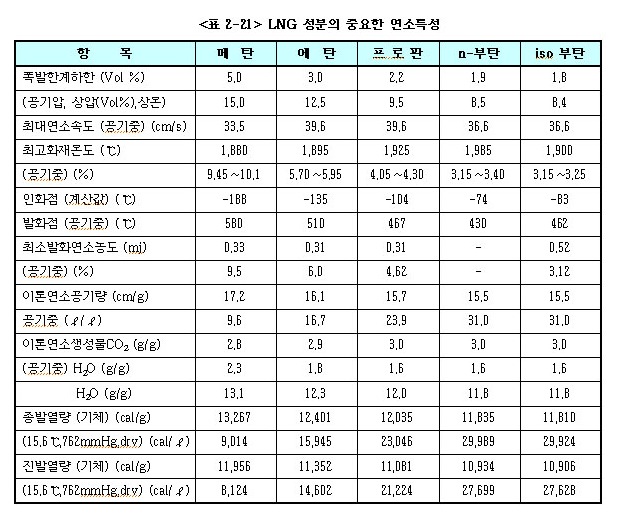
㉮ LNG로부터 기화된 메탄가스 등은 공기 또는 산소와 혼합되면 폭발성 가스가 형성되므로 취급에는 주의가 필요하다.
㉯ LNG의 주성분인 메탄(CH4)은 다른 지방족 탄화수소에 비하여 연소속도가 늦으며, 최소 발화에너지, 발화점 및 폭발 하한계 농도가 높다.
㉰ LNG가 공기 중에 유출될 때는 저온 때문에 공기 중의 수분의 응축에 따라서 안개가 생기므로 이것에 의해 가스의 누설을 눈으로 식별할 수 있다.
㉱ LNG는 전기저항이 적으므로 유동, 여과, 적하 및 분무 등에 의한 정전기의 발생에 주의한다.
ⓒ LNG의 금속에 대한 부식성
LNG는 금속에 대한 부식성은 없으나, 저온 액체이므로 저장 용기가 알미늄, 오스테나이트 스테인레스강 등 FCC금속이 아닌 경우 저온취성을 일으킨다.
ⓓ LNG가 인체에 미치는 영향
LNG 자체는 독성은 없으나 단순 질식성 가스이므로, 고농도가 존재 할 경우 산소 결핍증에 주의한다.
ⓔ LNG가 도시가스 원료로서의 특성
㉮ LNG를 기화시킨 천연가스는 불순물이 거의 없어 탈황설비 등의 자체설비가 필요하지 않다.
㉯ 초저온의 액체이기 때문에 설비의 재료선택 및 취급에 특별한 주의가 필요하다.
㉰ 냉열이용이 가능하다.
㉱ 기화장치가 필요하다.
ⓕ LNG의 중요한 용도
㉮ 연료 : 도시가스, 발전용 연료, 공업용 연료
㉯ 냉각용 : 액화산소 및 액화질소의 제조, 냉동창고, 냉동식품, 저온분쇄(폐자동차 타이어, 대형 폐기물, 플라스틱), 해수담수화, 냉각(발전소 온배수의 냉각)
㉰ 화학공업 원료 : 메탄올, 암모니아의 냉각
(마) 수소가스 (Hydrogen gas, H2)
① 물리적 성질
ⓐ 상온에서 무색, 무미, 무취의 가연성 기체이다.
ⓑ 수소는 모든 가스 중에서 최소의 밀도 (가장 가볍다)를 가지며 확산속도, 열전도도가 대단히 크다. (수소의 확산속도:1.8km/sec)
ⓒ 고온일 때에는 강제나 기타 금속재료를 쉽게 투과한다.
ⓓ 열 전달율이 매우 크고 열에 대하여 안정하다.
② 화학적 성질
ⓐ 수소(부피) 2와 산소(부피) 1의 혼합가스는 550℃에서 격렬히 폭발적으로 반응하여 물을 생성한다.
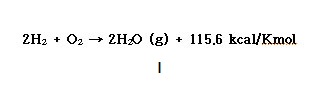
l
ⓑ 할로겐원소 (F2, Cl2, Br2, I2)와 격렬히 반응하여 폭발반응이 일어난다.

수소와 염소와의 혼합가스는 빛과 접촉하면 상온에서 심하게 반응하여 염화수소를 생성한다. 이를 염소 폭명기라고도 한다.
ⓒ 고온에서 금속 산화물을 환원시키는 성질이 있어 환원제로 쓰인다.
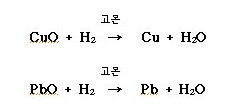
ⓓ 고온/고압에서 질소와 반응하여 암모니아를 생성한다.
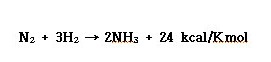
ⓔ 수소는 고온/고압에서 강재 중의 탄소와 반응하여 수소취성을 일으킨다.
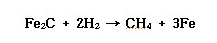
크롬을 5~6% 이상 함유하는 크롬강이나 스테인리스강에서는 이 현상은 일어나기 어렵고, 티탄(Ti), 바나듐(V), 텅스텐(W), 몰리브덴(Mo) 등을 첨가하면 내수소성이 좋아진다.
③ 용 도
ⓐ 암모니아 합성의 원료가스이며 기타 메탄올의 합성원료로 사용한다.
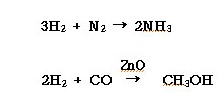
ⓑ 환원성을 이용해서 금속제련에 사용하거나 로 브레이징시 분위기 가스로 사용된다.
ⓒ 기구나 풍선에 충전하여 부양용으로 쓰인다. (지금은 He 사용)
ⓓ 로켓의 연료로서 쓰인다.
ⓔ 산수소 불꽃을 만들어 용접, 브레이징, 솔더링에 이용한다.
ⓕ 불포화기름을 포화기름으로 만드는데 이용한다.(경화유)
(바) 산 소 (Oxygen, O2)
① 물리적 성질
ⓐ 상온에서 무색, 무취, 무미의 기체이며 물에는 약간 녹는다.
ⓑ 기체, 액체, 고체에 관계없이 상자성 (자장의 방향으로 자화되는 것)을 가지고 있다.
ⓒ 공기 중에 약 21%함유되어 있고, 연료의 연소에 있어서 반드시 필요한 가스이다.
ⓓ 강력한 조연소성(助燃燒性) 가스이나 그 자신은 연소하지 않는다.
ⓔ 액화산소는 담청색을 띤다.
② 화학적 성질
ⓐ 화학적으로 활발한 원소이며 할로겐 원소, 백금, 금 등의 귀금속 이외의 모든 원소와 직접 화합하여 산화물을 만든다.
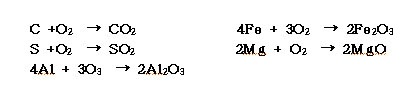
ⓑ 산소 또는 공기 중에서 무성방전을 행하면 오존 (O3)이 된다.
ⓒ 연소에 관한 성질
㉮ 산소농도나 산소분압이 높아짐에 따라 연소속도의 급격한 증가, 발화온도의 저하, 화염 온도의 상승, 화염길이가 증가된다.
㉯ 폭발한계 및 폭굉한계도 공기 중과 비교하면 산소 중에서 현저하게 넓고, 물질의 점화 에너지도 저하하여 폭발의 위험성이 증대한다.
㉰ 고압에서 산소를 사용하는 경우는 유기물 특히 유지류와 접촉시키는 것은 위험하므로, 만일 유지류가 부착 되어 있을 때에는 사염화탄소 (CCl4) 등의 용제로 세척하고 충분히 건조한 다음 사용한다.
ⓓ 유해성
㉮ 사람이 존재하고 있는 곳에는 산소농도는 18%이상으로 유지하여야 한다.
㉯ 산소가 과잉 또는 순산소의 경우에는(60% 이상의 고농도) 12시간 흡입하면 폐에 출혈을 일으켜 소아나 소동물은 실명, 사망할 수 있다.
③ 용 도
ⓐ 가스와 혼합하여 토치로 화염을 만들어 금속절단이나 용접, 브레이징, 솔더링 작업에 사용한다.
ⓑ 합성원료가스 제조에서의 탄화수소 부분 산화용, 제철용, 로켓 추진용, 액체산소 폭약 등에 사용한다.
ⓒ 잠수부, 중환자의 호흡, 항공기 조종사의 호흡, 사진용 전구.
④ 산소의 취급 주의사항
ⓐ 공기액화 분리기 내에 설치된 액화산소통 내의 액화산소는 1일 1회 이상 분석하고, 액화산소 5ℓ 중 아세틸렌의 질량이 5mg 또는 탄화수소의 탄소 질량이 500mg을 넘을 때에는 공기액화 분리기의 운전을 중지하고 액화 산소를 방출한다.
ⓑ 액화산소 5ℓ 중 아세틸렌 및 탄소 검출시약

ⓒ 석유류, 유지류, 글리세린 또는 농후한 글리세린은 산소압축기의 내부 윤활제로 사용하지 말 것.
ⓓ 산소 압축기의 내부 윤활유는 물 또는 10%이하의 묽은 글리세린수를 사용한다.
ⓔ 산소의 용기는 탄소강으로 이음매가 없는 용기이다.
ⓕ 산소가스 용기의 안전밸브는 박판식 (파열판식) 안전밸브를 사용한다.
ⓖ 용기의 도색은 일반 공업용이 녹색, 의료용은 백색이다.
ⓗ 고온/고압의 산소는 산화력이 강하다. 크롬강이나 규소 또는 알루미늄 첨가 강이 내산화성이 있다.
(사) 질 소 (Nitrogen, N2)
① 물리적 성질
ⓐ 공기 중에 부피로 78%를 함유하고 있다.
ⓑ 상온에서 무색, 무미, 무취의 기체이다.
ⓒ 상온에서 다른 원소와 반응하지 않는 안정한 기체로, 불연성 가스이다.
② 화학적 성질
ⓐ 고온/고압(550℃, 250atm)에서 수소와 반응시키면 화합하여 암모니아를 생성한다.

ⓑ 전기불꽃 등 극히 높은 온도에서 산소와 반응하여 산화질소가 된다.

ⓒ Mg, Ca, Li 등과 화합하여 질화마그네슘(Mg3N2), 질화칼슘(Ca3N2), 질화리튬(Li3N) 등의 질화물을 만든다.

③ 용 도
ⓐ 용접, 브레이징, 솔더링 시 금속의 산화를 막기 위한 가스로 사용된다.
ⓑ 로 브레이징시 수소가스와 함께 분위기 가스로 사용된다.
ⓒ 전구에 넣어서 텅스텐의 산화(연소)를 막는다.
ⓓ 질산, 요소, 암모니아 등의 화합물을 만든다.
ⓔ 최근에는 액체질소가 식품(야채 또는 식육)등의 급속 냉동용에 사용된다.
ⓕ 석회질소 제조용으로 사용한다.
(3) 토치 브레이징법의 종류
아래 그림 2-69)은 주요 가스 토치 브레이징 방법을 나타낸 것이다. 이 방법은 편의상 나누어 놓은 것으로, 이 밖에도 많은 자동 및 수동 방식이 존재한다.
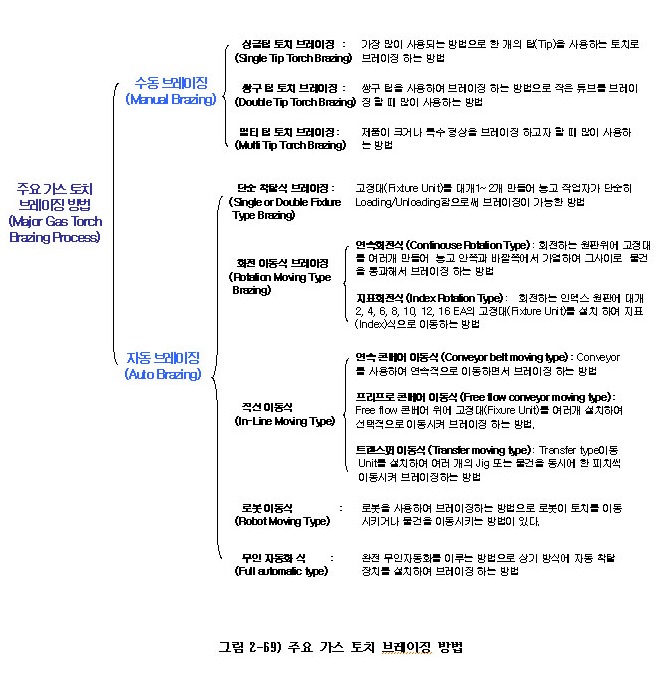
(가) 수동 가스 토치 브레이징 방법
수동 가스 토치 브레이징 방법은 편의상 사용하는 토치에 따라 그림 2-70)과 같이 나누고자 한다.
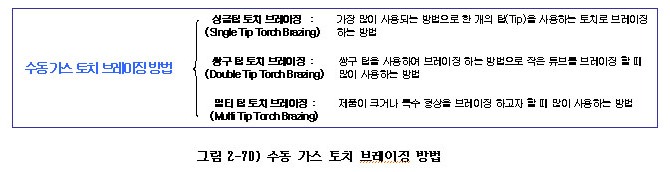
① 싱글 팁 토치 브레이징
단구 토치 브레이징이라고도 하며, 가스 토치 브레이징 중 가장 많이 사용되는 방법으로 아래 그림 2-71)과 같이 한 개의 팁을 사용하여 브레이징하는 방법이다.

② 쌍구 팁 토치 브레이징
그림 2-72)와 같이 두개의 팁을 사용하여 생산성 및 브레이징의 편의성을 도모하는 방법으로, 주로 작은 튜브를 브레이징 할 때 많이 사용한다.

|